Febrilní neutropenie
Definice
Febrilní neutropenie (FN) je definovaná jako stav s tělesnou teplotou měřenou orálně >38,3 °C; nebo teplotou 38 °C a vyšší, přetrvávající déle než 1 hodinu; nebo vzestupem teploty na nejméně 38 °C dvakrát během 24 hodin; ke kterému dochází v době poklesu absolutního počtu neutrofilů (ANC) v periferní krvi <0,5 × 109/l (nebo 1,0× 109/l s předpokladem dalšího poklesu).
FN zůstává jednou z nejčastějších a nejzávažnějších komplikací protinádorové léčby. Je hlavní příčinou morbidity a změn v plánované onkologické léčbě, jež vedou k jejímu oddálení a často i redukci dávek. Riziko FN je individuální, výrazně však narůstá s výskytem rizikových faktorů, které mohou být spjaty s pacientem nebo souviset s aplikovanou léčbou.
Rizikové faktory
FN vzniká nejčastěji (až 74 % epizod) v průběhu prvních 2 sérií chemoterapie (CHT). Existuje jasné spojení mezi závažností neutropenie a intenzitou CHT. Chemoterapeutické režimy lze z hlediska incidence FN klasifikovat jako vysoce rizikové (>20 %), středně rizikové (10-20 %) nebo nízce rizikové (<10 %). Mezi vysoce rizikové režimy patří např. „dávkově denzní“ chemoterapeutické režimy, ale i jiné kombinované režimy. Jejich přehled udává tabulka č. 1.
Tab. č. 1: Režimy vyvolávající epizody FN s pravděpodobností vyšší než 20%
|
Nádorová diagnóza |
Chemoterapeutický režim |
|---|---|
| Karcinom prsu | TAC; AT; AD |
| Karcinom vaječníků | topotekan |
| Karcinom plic | PE |
| Karcinom žaludku a gastroezofageální junkce | TCF |
| Karcinom slinivky břišní | FOLFIRINOX |
| Karcinom ledviny | GEM/DOX |
| Karcinom močového měchýře | M-VAC |
| Testikulární nádory | BEP; EP; VeIP; VIP; TIP |
| Sarkomy | MAI |
K rizikovým faktorům FN vedle samotné chemoterapie patří zejména věk (vyšší riziko FN u starších osob s vyšší morbiditou i mortalitou), dále pokročilost onemocnění, anamnéza předchozí FN, mukozitida, špatný celkový stav nebo kardiovaskulární onemocnění. Mezi rizikové faktory lze zařadit i nepoužívání antibiotické profylaxe. Riziko FN a komplikací s ní spojených narůstá při přítomnosti komorbidit. Z hlediska prognózy patří mezi špatné prognostické známky přítomnost bakteriémie nebo fokální infekce.
Celkově lze rizikové faktory vzniku FN hodnotit takto:
1. Rizikové faktory vzniku FN související s protinádorovou léčbou:
- myelotoxická CHT vedoucí k nadiru neutrofilu <0,5x109/l a k délce trvání neutropenie Grade 4 > 5dní (pravděpodobnost vzniku teploty stoupá o přibližně 10% s každým dnem, kdy je hodnota neutrofilů < 0,5x109/l)
- předpokládaný pokles neutrofilů <0,1x109/l
- samostatným rizikovým faktorem je nadir neutrofilů <0,25x109/l a lymfocytů <0,7x109/l
- konkomitantní RT
- závažné poškození slizničních a kožních bariér (G3 a G4 toxicita)
2. Rizikové faktory vzniku FN související se stavem pacienta:
- přítomnost 2 a více závažných komorbidit (CHOPN, DM, srdeční selhávání nebo hemodynamicky nestabilní pacient – hypotenze, arytmie), špatný nutriční stav, přítomnost anemického syndromu, nízký PS, nedostatečné renální funkce (glomerulární filtrace <30ml/s), infiltrace kostní dřeně nebo předchozí RT na rozsáhlou část osového skeletu, primární imunodeficit)
- věk ≥65 let
- přítomnost otevřené rány, dočasných katetrů a/nebo akutní infekce
- sepse/závažná infekce v období uplynulých 4 týdnů
- vznik FN v průběhu hospitalizace
- nedostatečná compliance pacienta.
Primární profylaxe
Za určitých okolností je vhodné těmto stavům předcházet použitím růstových faktorů myelopoézy (G-CSF). Je doporučeno tyto přípravky používat u pacientů, kteří dostávají chemoterapeutický režim, u něhož existuje >20 % riziko rozvoje FN, a u nemocných se závažnými komorbiditami a/nebo ve věku >65 let. Profylaktické použití G-CSF je racionální pouze v případě protinádorové léčby s kurativním záměrem nebo paliativní léčby prokazatelně prodlužující celkové přežití pacientů nebo dobu do progrese onemocnění. I v případě použití G-CSF k profylaxi FN by nemělo být opomenuto realizovat režimová opatření vedoucí ke snížení rizika výskytu infekce v době neutropenie, včetně sanace infekčních fokusů. Postup při rozhodování o primární profylaxí růstovými faktory myeloidní řady ukazuje obrázek č. 1.
Obr. č. 1: Doporučení pro primární profylaxi FN růstovými faktory myelopoézy (G-CSF)
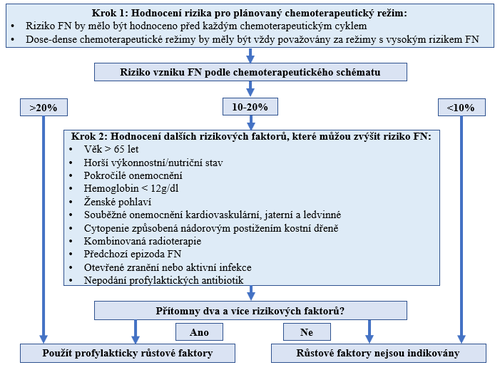
V primární profylaxi neutropenie u paliativní léčby lze zvážit redukci dávky CHT nebo její odklad, případně myslet na použití jiného chemoterapeutického režimu s ekvivalentní protinádorovou účinností, ale s nižším rizikem FN.
Sekundární profylaxe
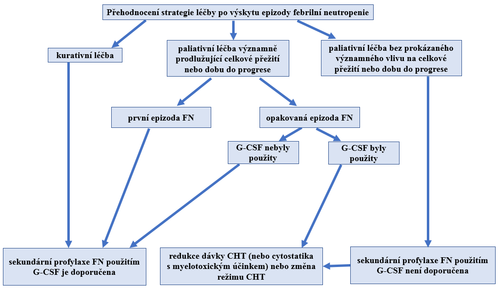
Proběhlá epizoda FN je samostatným rizikovým faktorem výskytu dalších epizod FN v průběhu dané CHT. Doporučuje se použití sekundární profylaxe, a to jen v případě kurativní léčby nebo paliativní léčby prokazatelně prodlužující celkové přežití pacientů nebo dobu do progrese onemocnění. Alternativním řešením v případě paliativní léčby je opět redukce dávky CHT nebo její změna za režim s nižší myelotoxicitou. Doporučení pro sekundární profylaxi FN shrnuje obrázek č. 2.
Obr. č. 2: Doporučení pro sekundární profylaxi FN růstovými faktory myelopoézy (G-CSF)
Diagnostika
Úspěch zvládnutí FN vyžaduje rychlé rozeznání potenciální infekce a rychlou reakci. Klíčové je edukovat pacienty z hlediska monitorování symptomů, včetně tělesné teploty. Současně je vhodné poskytnout pacientům srozumitelné psané instrukce týkající se toho, jak a kdy mají kontaktovat ošetřující centrum v případě potíží. Základem je existence lokálních doporučení týkajících se managementu FN zajišťující okamžitou rychlou reakci, a to i v případě vyšetření pacienta na pohotovosti nemocnice. V rámci uvedených doporučení je nutná znalost lokální epidemiologie.
Při vstupním vyšetření pacienta s FN či suspektní FN je nutno provést následující kroky:
- Ujistit se, zda má pacient zaveden i. v. katétr.
- Zhodnotit symptomy odkazující na možný fokus infekce (respirační systém, GIT, kůže, perineální/genitouretrální změny, orofarynx, CNS, místa po injekčních aplikacích).
- Zkontrolovat klinické záznamy a posoudit předchozí pozitivní mikrobiologické výsledky.
- Provést urgentní odběry zahrnující krevní obraz, hemokultury (s minimem 2 setů zahrnujících odběr jak z periferní žíly, tak i z každého lumen centrálního žilního katetru) a další mikrobiologická vyšetření. Dalším standardním vyšetřením je skiagram hrudníku, který se provádí s cílem potvrdit nebo vyloučit zánětlivý plicní infiltrát. Bronchoalveolární laváž je indikována velmi zřídka v případě podezření na závažnější formy mykotické infekce. Při suspektní infekci CNS se provádí vyšetření mozkomíšního moku.
Vyhodnocení závažnosti
V rámci hodnocení rizika FN se používá řada nástrojů. Jedním z nejvíce používaných je index MASCC (vytvořený Multinational Association of Supportive Care in Cancer), jenž umožňuje lékařům rychlé posouzení rizika na podkladě klinických známek. Má pozitivní i negativní prediktivní hodnotu a schopnost rozlišit prostou a komplikovanou epizodu FN. Index byl validován v několika studiích a zahrnuje následující charakteristiky (viz. tabulka č. 2):
- závažnost nemoci (žádné či mírné, středně významné a závažné symptomy: 5−3−0 bodů),
- nepřítomnost hypotenze (5 bodů),
- nepřítomnost obstrukční plicní nemoci (4 body),
- solidní nádor či lymfom bez předchozí mykotické infekce (4 body),
- nepřítomnost dehydratace (3 body),
- ambulantní pacient při nástupu teploty (3 body),
- věk <60 let (2 body).
Tab. č. 2: Výpočet indexu rizikovosti epizody FN podle MASCC
|
Příznak/stav |
Bodové ohodnocení |
|---|---|
| Žádné nebo mírné příznaky základní nemoci |
5 |
| Závažnější příznaky základní nemoci |
3 |
| Nepřítomnost hypotenze |
5 |
| Nepřítomnost CHOPN |
4 |
| Solidní nádor |
4 |
| Nepřítomnost předchozí mykotické infekce |
4*) |
| Pacient ambulantní v době epizody FN |
3 |
| Nepřítomnost dehydratace |
3 |
| Věk pod 60 let |
2 |
Pozn.: *) Hodnotíme pouze u nemocných s hematologickými malignitami
Index umožňuje stanovit riziko komplikací – čím vyšší skóre, tím nižší riziko (nízké riziko je stanoveno při skóre ≥ 21). S antibiotiky je nutné nakládat racionálně. V případě pacientů s nízkým rizikem komplikací je možné podávat perorální antibiotika (již od počátku) a lze zvážit i ambulantní léčbu, pokud je zajištěno vhodné následující sledování – dobrá spolupráce pacienta a rodiny, telefonické spojení 24 hodin denně, možnost dopravy do nemocnice do 1 hodiny pro případ neočekávaných komplikací. Výhody ambulantní léčby spočívají v nižším riziku nákazy multirezistentními nozokomiálními kmeny, v lepší kvalitě života nemocných a v nižší ceně léčby.
Pacienti s FN ve vysokém riziku komplikací (MASCC skóre <21 nebo s rizikovými klinickými projevy při iniciálním vyšetření) mají být přijati k hospitalizaci a léčba širokospektrými antibiotiky má být zahájena bezodkladně. Současně je nutno pacienty velmi pečlivě monitorovat s ohledem na známky hemodynamické nestability.
Tab. č. 3: Antibiotika v empirické léčbě FN
| Antibiotika nevhodná k empirické léčbě FN v monoterapii |
|
| Antibiotika vhodná k empirické monoterapii FN za hospitalizace |
|
| Antibiotika vhodná k empirické kombinační léčbě FN za hospitalizace |
|
| Antibiotické kombinace vhodné k empirické ambulantní léčbě FN |
|
Pozn.: +/- účinnost léčby se ověřuje v klinických studiích, není rutinně používaná, její efekt se přepokládá
Léčba epizody FN podáním antibiotik (ATB)
Volba ATB předpokládá úzkou spolupráci s antibiotickým střediskem a znalost aktuální mikrobiologické situace. Denně je nutno posuzovat trend teploty, funkce kostní dřeně a renální funkce, zejména do vzestupu ANC ≥ 0,5 × 109/l a dosažení afebrilního stavu trvajícího nejméně 24 hodin.
Při léčbě epizody FN se volí zásadně z baktericidních antibiotik. Spektrum účinnosti musí vykrýt základní gram-negativní patogeny (Pseudomonas spp., E. coli, Klebsiella spp.) a základní gram-pozitivní patogeny (Streptococcus spp., Staphylococcus spp.). Do současné doby neprokázala žádná rozsáhlejší studie přednost jednoho empirického režimu před jiným. O volbě antibiotik rozhoduje aktuální mikrobiální situace na pracovišti, intenzita prováděné protinádorové léčby, očekávaná délka neutropenie a závažnost dalších přidružených onemocnění. Perorální ATB terapie při nekomplikované epizodě FN je stejně účinná jako léčba nitrožilní.
Pro léčbu 1. linie je na pracovištích KOC s ohledem na aktuální stav citlivostí a rezistencí mikroorganismů doporučeno:
- pro ambulantní léčbu kombinace ciprofloxacinu (2x500mg denně p.o.) s ko-amoxicilinem (2x 1 g denně p.o.)
- pro málo rizikové hospitalizované pacienty monoterapie betalaktamem s antipseudomonádovou aktivitou: cefepim (2x2 g i.v.), ceftazidim (3x1 g i.v.) nebo piperacilin/tazobaktam (3x4,5 g i.v.)
- pro klinicky nestabilní hospitalizované pacienty – kombinace betalaktamu a aminoglykosidu (gentamicin, netilmicin, amikacin, isepamicin v dávkování 1x denně)
Glykopeptidová antibiotika (vankomycin, teikoplanin) je nezbytné považovat za rezervní. Nasazují se obvykle až při přetrvávání teplot po 3-4 dnech intenzivní léčby empirickými antibiotiky. V úvodní empirické léčbě je vhodné podávat glykopeptidová antibiotika pouze tehdy, je-li febrilní neutropenie doprovázena šokovým stavem, nebo se na pracovišti vyskytují methicilin-rezistentní kmeny Staphylococcus spp. Úvodní léčba se provádí 3-4 dny s následným vyhodnocením efektu.
Při bolestech břicha a/nebo průjmu je třeba uvažovat o anaerobní střevní infekci, zejména klostridiové, léčbu tedy doplníme o metronidazol nebo klindamycin.
Při přetrvávání nebo progresi teplot se léčba upravuje buď podle výsledku citlivosti nebo empiricky změnou antibiotik nebo přidáním antimykotik, užívají se antimykotika fungicidní. Itrakonazol v dávce 5 mg/kg/den je lékem první volby na pracovištích KOC, neboť až 40 % izolátů tvoří kmeny kandid non-albicans, které jsou primárně rezistentní k flukonazolu. U většiny nemocných však klinicky zjevná mykóza přítomna není, proto zařazujeme antimykotika spíše až ve 2. linii v okamžiku selhávání empirické léčby (neplatí pro hematologické malignity).
Při zahájení empirické léčby není indikace k nasazení antivirotik bez průkazu virové infekce. O virové infekci je třeba uvažovat při perzistujících teplotách i po normalizaci počtu leukocytů.
U asymptomatického a afebrilního pacienta po dobu 48 hodin, při negativitě hemokultur a vzestupu ANC na ≥ 0,5 × 109/l, je možné antibiotickou terapii přerušit. U pacienta s ANC stále <0,5 × 109/l bez komplikací, jenž je afebrilní po dobu 5−7 dnů, může být podávání antibiotik také přerušeno (s výjimkou některých nemocných s vysokým rizikem, zejména při léčbě leukémií nebo po vysokodávkované chemoterapii).
V případě vzniku 2. epizody FN u téhož pacienta je vhodné použít jiná ATB, než byla použita v léčbě první epizody. Výhodou cefalosporinů IV. generace oproti cefalosporinům III. generace je jejich vyšší aktivita proti grampozitivním bakteriím. Karbapenemy je vhodné považovat za rezervní ATB mající výhodu širokého spektra. Přehled ATB v empirické léčbě febrilní neutropenie uvádí tabulka č. 3.
Léčba epizody FN podáním G-CSF
Není doporučeno rutinní užívání G-CSF v léčbě nekomplikované FN. Randomizované studie prokázaly, že podání růstových faktorů myeloidní řady zkracuje délku trvání neutropenie, zvyšuje léčebnou odpověď na antibiotický režim a v několika studiích také zkracuje délku hospitalizace. Nesnižuje úmrtnost na FN a nezkracuje dobu podávání antibiotik. Z aplikace G-CSF v době vzniku nebo v průběhu FN má prospěch pouze skupina nemocných s přítomností závažných komplikací nebo s rizikovými faktory jejich rozvoje. Jedná se o nemocné s:
1) FN komplikovanou: multiorgánovým selháváním při septickém syndromu, kardiopulmonálním selháváním, generalizovanou mykotickou infekcí nebo zánětlivým plicním infiltrátem
2) rizikovými faktory morbidity a mortality FN (v době vzniku/v průběhu FN):
- související s protinádorovou léčbou: protrahovaná (≥ 10 dnů) neutropenie <0,5x109/l; pokles neutrofilů <0,1x109/l; pokles CD4+ lymfocytů ≤0,2x109/l
- související se stavem pacienta: přítomnost 2 a více závažných komorbidit (CHOPN, DM, špatný nutriční stav, přítomnost anemického syndromu, nízký PS, primární imunodeficit, zmatenost); věk ≥ 65 let; přítomnost otevřené rány, dočasných katetrů a/nebo akutní infekce; vznik FN v průběhu hospitalizace; závažné poškození slizničních bariér (toxicity G3 a G4); nedostatečná compliance pacienta; renální selhání; hemodynamická nestabilita (hypotenze, arytmie); krvácení, DIC.
Pokud FN vznikne v době profylaktického podávání G-CSF, pak je-li podáván filgrastim, pokračuje se dál v jeho aplikaci, pokud byl profylakticky podáván pegfilgrastim, další G-CSF se již neaplikují.
Dávkování a způsob podání přípravků G-CSF
Výběr přípravku G-CSF závisí na rozhodnutí lékaře. V případě biosimilars byla u všech registrovaných přípravků (Accofil, Biograstim, Grastofil, Nivestim, Ratiograstim, Tevagrastim, Zarzio) prokázána stejná biologická účinnost a zaměnitelnost s originálním přípravkem. Dávkování Filgrastim (originální přípravek Neupogen) a biosimilars G-CSF: 0,5 MIU (5ug) /kg/den. Z důvodu růstové stimulace myeloidních buněk by první dávka filgrastimu neměla být podána v rozmezí 24 hodin před a 24 hodin po cytotoxické chemoterapii. Filgrastim může být podáván denně, upřednostňována je aplikace podkožní injekcí. Denní podávání filgrastimu by mělo pokračovat až do doby, než byla překonána nejnižší očekávaná hranice množství (nadir) neutrofilů a než se jejich počet vrátil zpět do normálního rozmezí. Pegfilgrastim (Neulasta), lipegfilgrastim (Lonquex): 6 mg/cyklus chemoterapie. U osob s hmotností 45 kg a vyšší je doporučená jednorázová podkožní aplikace pegylovaných filgrastimů 6 mg na jeden cyklus chemoterapie. Pegylovaný filgrastim by neměl být podán dříve než za 24 hodin po cytotoxické chemoterapii a zároveň ne později, než 14 dní před zahájením dalšího cyklu léčby. Jeho použití je tak vhodnější u chemoterapie s 3týdenními cykly.
Nejčastějším nežádoucím účinkem, který byl pozorován v souvislosti s podáváním G-CSF, byly bolesti pohybového systému mírné až střední intenzity. Tyto bolesti lze obvykle potlačit běžnými analgetiky. Filgrastim nesmí bát podáván pacientům s těžkou vrozenou (kongenitální) neutropenií (Kostmanův syndrom). Bezpečnost a účinnost podávání filgrastimu a pegylovaného filgrastimu pacientům s myelodysplastickým syndromem nebo chronickou myeloidní leukémií nebyla dosud stanovena, jejich podání není u těchto diagnóz indikováno. Celkově je v prevenci FN pegylovaný filgrastim účinnější než filgrastim.
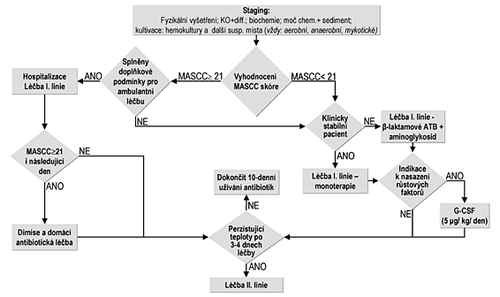
Obrázek č. 3 zobrazuje schéma managementu febrilní neutropenie.
Obr. č. 3: Management febrilní neutropenie:
Literatura:
1. Klastersky J., Naurois J., Rolston K. et al. Management of febrile neutropaenia: ESMO Clinical Practice Guidelines. Ann Oncol 2016; 27 (Suppl. 5): v111−v118, doi: 10.1093/annonc/mdw325.
2. NCCN Clinical Practice Guidelines in Oncology™, Myeloid Growth Factors, V. 2. 2017. Dostupne z: https://jnccn.org/view/journals/jnccn/15/12/article-p1520.xml
3. Aapro MS, Bohlius J, Cameron DA, et al. 2010 update of EORTC guidelines for the use of granulocyte-colony stimulating factor to reduce the incidence of chemotherapy-induced febrile neutropenia in adult patients with lymphoproliferative disorders and solid tumours., Eur J Cancer. 2011 ;47(1):8-32.
4. Klastersky J, Awada A. Prevention of febrile neutropenia in chemotherapy-treated cancer patients: Pegylated versus standard myeloid colony stimulating factors. Do we have a choice?,Crit Rev Oncol Hematol. 2011;78(1):17-23.
5. Choi CW, et al. Early lymphopenia as a risk factor for chemotherapy-induced febrile neutropenia. Am J Hematol. 2003;73(4):263-6.
6. Tomiška M, Burgetova D, Račil Z, Adam Z. Lečba infekci u pacientů s malignimi chorobami. In: Adam Z, et al. Obecna onkologie a podpůrna lečba, Grada 2003, pp 437-497.
7. Doporučeny postup lečby febrilni neutropenie v Masarykově onkologickem ustavu v Brně. http://www.mou.cz/file.html?id=103.
9. Vogel CL, Wojtukiewicz MZ, Carroll RR, etl. al. First and Subsequent Cycle Use of Pegfilgrastim Prevents Febrile Neutropenia in Patients With Breast Cancer: A Multicenter, Double-Blind, Placebo-Controlled Phase III Study. J Clin Oncol 2005;23:1178-1184.
10. Cooper KL, Madan J, Whyte S, Stevenson MD, Akehurst RL Granulocyte colony-stimulating factors for febrile neutropenia prophylaxis following chemotherapy: systematic review and meta-analysis., BMC Cancer. 2011 Sep 23;11:404.